신약 개발 관련 기사를 보다 보면 “Preclinical”, “IND-enabling”, “Phase 1”, “2a 임상” 같은 용어들이 한꺼번에 등장해 헷갈릴 때가 많죠. 특히 알테오젠·리가켐바이오·에이비엘바이오·올릭스처럼 임상 단계가 다양한 바이오 기업에 투자할 때는 각 용어가 무엇을 의미하는지 정확히 이해하는 것이 정말 중요합니다. 오늘은 바이오·제약 기업들이 파이프라인 표에서 사용하는 개발 단계 용어를 처음부터 끝까지 가장 쉽게, 하지만 투자 관점까지 고려해 깊이 있게 정리해드릴게요.
신약 개발의 전체 흐름 한눈에 보기
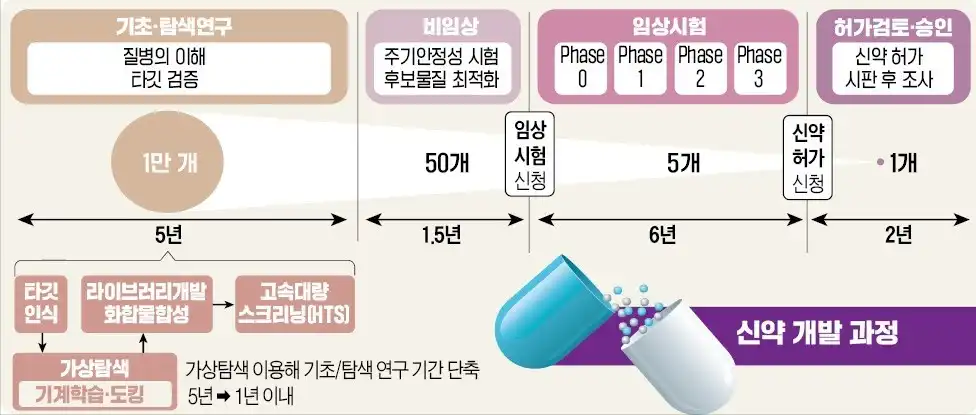
신약 하나가 시장에 나오기까지는 보통 10년 이상이 걸리고, 수천억 원의 비용이 필요합니다.
크게 나누면 아래 순서대로 진행돼요.
- Discovery(탐색 연구)
- Preclinical(비임상)
- 동물·세포 실험
- 후기 단계는 IND-enabling이라 부르기도 함
- Clinical(임상)
- Phase 1
- Phase 2a / 2b
- Phase 3
- 허가 및 시판 후 모니터링(Phase 4)
이제 각 단계가 무엇을 의미하는지 하나씩 살펴볼게요.
Discovery(탐색 연구) – 신약 개발의 가장 첫 단계
Discovery 단계
- 질병의 원인, 타깃(단백질, 수용체 등)을 찾고
- 그 타깃에 붙는 후보물질(신약 후보)을 찾는 단계입니다.
주요 작업
- 타깃 발굴: “어떤 단백질을 조절하면 병이 좋아질까?”
- Hit 발굴: 대량 스크리닝(HTS 등)으로 “약이 될 만한” 물질 찾기
- Hit to Lead: 후보군 중에서 더 약처럼 보이는 물질 선별
- Lead Optimization: 효능·독성·약동학(혈중농도, 반감기 등)을 개선하며 구조 최적화
- 가장 초기·하이리스크·하이리턴 구간
- 성공 확률은 낮지만 기술이전(licensing-out)이 되면 멀티플이 크고,
- 논문·학회 발표/초기 빅파마 공동연구 등이 주요 모멘텀.
Preclinical(비임상) – 사람에게 투여 전 안전성·효능 검증 단계
Preclinical의 의미
- 사람에게 투여하기 전 세포·동물실험으로 안전성·효능을 검증하는 단계입니다.
- 일반적으로 “Preclinical”이라고 하면 Discovery 이후 ~ IND 제출 전까지 전체 비임상을 통칭합니다.
주요 내용
- 효능 시험(Efficacy): 동물 모델(쥐 등)에서 정말 병이 좋아지는지 확인
- 독성 시험(Toxicology): 특정 장기 독성, 반복 투여 독성 등
- 약동·약력(PK/PD): 흡수, 분포, 대사, 배설, 혈중농도-시간, 효과-농도 관계 등
- 제제 개발(Formulation): 약을 어떤 형태(정제, 주사제 등)로 만들지, 안정성은 어떤지
보고서/IR에서 “Preclinical”이라고만 써 있으면
아직 사람에게 투여해 본 적 없고, 동물·시험관 수준에서 검증 중이라고 이해하시면 됩니다.
IND-enabling – 임상시험 직전 단계
IND(Investigational New Drug)란?
- 미국 기준으로 FDA에 임상시험을 허가받기 위해 제출하는 신청서입니다.
- 우리나라로 치면 식약처 임상시험계획(IND) 승인 신청과 유사한 개념이에요.
- IND 패키지 안에는
- 비임상 독성·효능 데이터
- CMC(제조·품질 관리) 데이터
- 임상시험 프로토콜(어떻게, 누구에게, 얼마나 투여할지) 등이 들어갑니다.
IND-enabling Study 단계
1) 개념
- 넓은 의미의 Preclinical 중에서도 “이제 곧 IND를 제출하기 위해 필요한 핵심 비임상 시험을 마무리하는 구간”을
IND-enabling이라고 부릅니다.
2) 주요 특징
- GLP(우수실험실규정) 기준 독성시험
- 반복투여 독성, 유전독성, 안전성약리 등 규제기관이 요구하는 포맷대로 수행
- CMC(제조공정/품질) 확립
- 임상 1상 프로토콜 설계
그래서 기업 소개자료에 IND-enabling / Pre-clinical 이라고 쓰여 있으면:
“비임상 후반부, 이제 곧 임상 1상 진입을 목표로 IND용 패키지를 만들고 있다”
정도로 해석하면 됩니다.
(Preclinical 중에서도 임상 직전에 위치한 상당히 중요한 마일스톤 구간)
Clinical(임상) – 사람에게 투여하며 효과·안전성 검증
임상시험은 크게 1상 → 2상 → 3상 순서로 진행됩니다.
여기서 임상 전체를 통칭할 때 Clinical 또는 임상이라고 표기합니다.
- 간단히 말해 사람을 대상으로 하는 시험입니다.
- 각 나라 규제기관(식약처, FDA 등)의 승인을 받고, 피험자(건강인/환자)에게 실제로 약을 투여하며 안전성·유효성을 단계적으로 확인합니다.
- 기업 자료에 그냥 Clinical 또는 임상만 써 있을 때는 “임상 전체(Phase 1~3 중 한 단계 이상)”를 통칭하는 경우가 많고,
- 보통은 옆에 Phase 1, Phase 2 등 구체 단계가 같이 붙습니다.
Phase 1 – 인간 대상 첫 투여, 안전성 확인 단계
목적
- 사람에게 처음 투여하는 단계
- 가장 큰 목적은 안전성(Safety)과 약동학(PK) 확인입니다.
- 건강한 지원자(healthy volunteer)에게 투여하는 경우가 일반적이지만,
항암제/고위험 약물은 환자에게 바로 1상을 하기도 합니다.
특징
- 소규모(수십 명 내외)
- 단일상승용량(SAD: Single Ascending Dose)
→ 용량을 조금씩 올려가며 부작용·혈중농도 확인 - 반복상승용량(MAD: Multiple Ascending Dose)
→ 여러 번 투여했을 때 안전성, 체내 축적 여부 확인 - 최대내약용량(MTD) 탐색: 어느 수준까지 견딜 수 있는지
- “인체에서의 안전성·약동 확인”이라는 큰 허들을 넘는 첫 단계
- 1상 진입 자체가 기업 가치에 의미 있는 모멘텀이고,
- 1상 완료(특히 안전성 양호, PK 양호) 시 기술이전(L/O) 가능성이 커지는 경우도 많습니다.
Phase 2 – 본격적인 효능 평가 단계
특히 중요한 2a / 2b의 차이, Phase 2는 2a와 2b로 나뉘며 의미가 조금씩 달라요.
Phase 2a – 탐색적 임상 PoC(Proof of Concept) 단계
목적
- 효과가 진짜로 있는지(Proof of Concept)를 처음으로 환자에서 확인하는 단계입니다.
- 1상에서 안전성이 어느 정도 확인된 약을 실제 환자(해당 적응증 환자)에게 투여해 “약효 시그널이 보이는지”를 보는 것.
특징
- 보통 환자 수가 비교적 적음(수십~100명 미만 정도인 경우가 많음)
- 용량 범위도 여러 개 테스트(용량 탐색)
- 평가변수(Endpoint)는 효과 유무의 신호를 보는 정도로 세팅
(예: 바이오마커 감소, 증상 점수 변화 등)
기업 IR에서 Phase 2a 진행 중 또는 2a PoC 확보 같은 표현이 나오면
- 아직 대규모 피벗 임상(2b/3상)의 전 단계이고
- “효과가 있을 것 같다는 초기 신호를 찾아가는 단계”라고 보면 됩니다.
- 2a에서 좋은 결과가 나오면 빅파마와의 기술이전/공동개발 협상이 활발해질 수 있는 포인트.
Phase 2b – 용량 확정·확증적 효능 평가 단계
목적
- 2a에서 얻은 신호를 바탕으로 적절한 용량과 투여 스케줄을 확정하고
- 2상 후반부의 보다 확증적인 효능 데이터를 쌓는 단계입니다.
2) 특징
- 환자 수가 2a보다 많음
- Placebo(위약) 대조, 활성 대조(active control) 등 설계가 더 엄격해지는 경우가 많음
- 여기서 정해진 용량·스케줄이 보통 3상 설계의 기준이 됨
보고서에 Phase 2a 완료 후 2b 설계 중 이런 표현이 있으면
- PoC는 어느 정도 확보했지만
- 아직 3상 진입 전, 중간 다리 단계라고 이해하면 됩니다.
Phase 3 – 승인 직전, 가장 큰 확증 임상 단계
Phase 3(임상 3상)은 신약 개발 과정에서 가장 규모가 크고, 가장 비용이 많이 들고, 가장 중요한 결론을 내리는 단계입니다.
쉽게 말해, “이 약을 시장에 내도 되는지”를 최종적으로 판단 받는 단계라고 보면 됩니다.
Phase 3의 목적
- 실제 환자 집단에서 효능(Efficacy)을 확실하게 증명
- 안전성(Safety) 문제는 없는지 장기적으로 확인
- 기존 치료제 대비 우월성 혹은 비열등성 비교
규제기관(FDA, 식약처)은 Phase 3 데이터를 기반으로 “이 약은 효과가 충분하고, 위험은 감당 가능하다”라고 판단해야만 허가를 내줍니다.
Phase 3의 특징
1) 환자 수 규모가 매우 크다
- 수백 명에서 많게는 수천 명
- 여러 국가에서 동시에 진행되는 Global Trial도 많음
- 예: 글로벌 항암제 3상은 1,000명 이상이 일반적
2) 무작위배정(RCT)·이중맹검·Placebo 대조 등 엄격한 설계
- Bias를 줄이기 위해 ‘이중맹검(double-blind)’과 무작위배정(randomization)이 필수
- 비교군은 Placebo 또는 기존 표준치료제(Standard of Care)
3) 투여 기간이 길다
- 몇 개월 ~ 몇 년 지속되는 경우도 많음
- 장기 안전성 확인이 핵심
4) 가장 많은 비용 소요
- 보통 전체 개발 예산의 절반 이상이 3상에서 발생
- 글로벌 3상 하나에 수백억~수천억 원이 들어갈 수 있음
Phase 3에서 평가하는 주요 요소
1. 효능의 통계적 유의성(Statistical Significance)
- p-value, hazard ratio 등
- 단순히 좋아지는 경향이 아니라 “정말 효과가 있다고 증명”해야 함
2. 임상적으로 의미 있는 개선(Clinical Benefit)
- 실제 환자가 체감할 만큼 좋아지는가?
- 생존기간 증가(OS), 무진행 생존기간(PFS), 증상 개선 등
3. 안전성(Safety)·부작용 관리
- 심각한 부작용 발생률 비교
- 장기 안전성 모니터링
4. 위험 대비 이득(Risk–Benefit)
- 규제기관이 가장 중요하게 보는 지표
- “효과가 부작용보다 더 크냐?”가 핵심 논점
Phase 3 성공 시 – 신약 허가(NDA/BLA) 절차로 진입
임상 3상에서 좋은 결과가 나오면 기업은 FDA 또는 식약처에 허가 신청을 하게 됩니다.
- 화학의약품 → NDA(New Drug Application)
- 바이오의약품 → BLA(Biologics License Application)
허가가 나면 드디어 제품 판매가 가능한 시판 단계(Phase 4)로 들어갑니다.
투자 관점에서 본 Phase 3
Phase 3는 기업 가치에 가장 큰 영향을 미치는 단계입니다.
✔ Phase 3 진입 자체가 높은 신뢰도를 의미
- Preclinical~2상을 모두 통과한 약물만 올라가는 단계이기 때문에 “임상 3상 시작”만으로도
- 해당 파이프라인의 기술적 신뢰도가 매우 높아졌음을 의미합니다.
✔ Phase 3 성공 = 사업적 가치 급증
- 글로벌 시장 진출 가능 / 허가 직전 단계
- 빅파마와 대규모 L/O 협상 가능
- 매출 예상치가 구체화되기 시작하는 시점
✔ 다만 리스크도 큰 단계
- 개발 비용이 가장 크고
- 실패 시 기업 가치가 급락하는 경우도 있음
- 글로벌 경쟁 약물 대비 우월성을 입증해야 하는 경우가 많기 때문
개발 단계별 한눈에 비교표
| 단계 | 주요 목적 | 사람 투여 | 특징 |
|---|---|---|---|
| Discovery | 타깃 발굴·후보물질 탐색 | X | 가장 초기, 리스크 가장 큼 |
| Preclinical | 동물·세포 실험으로 안전성·효능 확인 | X | 임상 진입 가능성 판단 |
| IND-enabling | IND 제출 위한 비임상 마무리 | X | 임상 1상 직전 핵심 구간 |
| Phase 1 | 안전성·PK 확인 | O | 첫 인체 투여 |
| Phase 2a | 초기 효능(PoC) 확인 | O | 기술이전 가능성↑ |
| Phase 2b | 용량 확정·확증적 효능 | O | 3상 설계 기반 |
| Phase 3 | 최종 효능·안전성 증명 | O | 허가 직전, 가장 중요한 임상 |
| Phase 4 | 시판 후 감시 | O | 장기 안전성·실제 사용 데이터 확보 |
“Preclinical” vs “Discovery / Pre-clinical” 표기 차이
간혹 파이프라인 표에서 다음과 같이 나옵니다. 이건 회사마다 단계 구분을 얼마나 잘게 나누는지의 차이입니다.
- Discovery / Pre-clinical
→ “탐색 연구와 초기 비임상이 섞여 있는 초·중기 전임상 단계” - Preclinical
→ 일반적인 비임상 전체, 또는 “Discovery는 끝났고 비임상 진행 중” - IND-enabling / Preclinical
→ “비임상 후반부, 임상 1상 진입 바로 직전”
바이오 기업의 파이프라인을 볼 때 “현재 어떤 단계에 있고, 다음 마일스톤이 무엇인지”만 정확히 파악해도 해당 기업의 리스크와 성장 가능성을 빠르게 판단할 수 있습니다.
특히 Phase 2a(효능 신호), IND-enabling(임상 직전), 그리고 Phase 1 진입 여부는 투자자들이 가장 주목하는 포인트이기도 합니다.
[함께 읽어볼 글]
조선기자재 보냉재, 한국카본·동성화인텍, LNG 3차 사이클 핵심 수혜주
젠슨 황이 꽂힌 SoCAMM! AI 기판 밸류체인 (심텍·티엘비 관련주 정리)
반도체 산화·어닐링 공정 밸류체인, AP시스템·이오테크닉스·디아이티·HPSP·예스티
반도체 포토 공정 밸류체인, 동진쎄미켐·에스앤에스텍·에프에스티·이엔에프테크놀로지
반도체 세정 공정 밸류체인, 코미코·한솔아이원스·제우스·케이씨텍·엘티씨